La classification AAP/EFP 2018 des maladies parodontales et péri‑implantaires
Numéro du cours: 610
Contenu du Cours
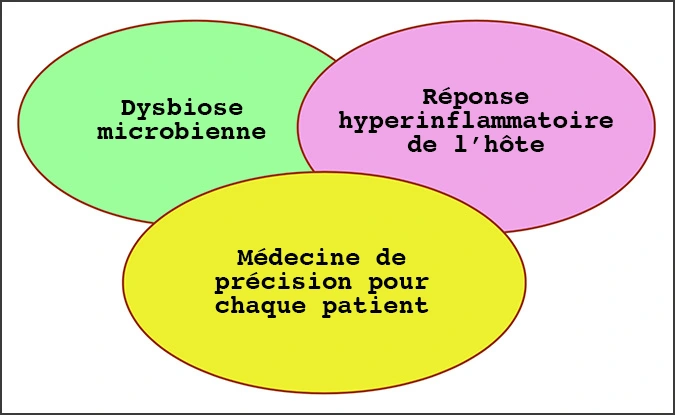
Principales dynamiques englobant la médecine de précision
La dynamique principale à l’origine de la création de la nouvelle classification des maladies parodontales a englobé les résultats du projet microbiote humain et le concept de médecine de précision. En 2007, les National Institutes of Health (NIH) des États-Unis ont lancé un vaste projet qui s’est transformé en une initiative internationale toujours en cours « The Human Microbiome Project ».13 Ces efforts aident les scientifiques et les cliniciens à mieux comprendre comment le microbiome humain et ses interactions avec le système immunitaire humain protègent leur hôte ou lui nuisent. Ces informations présentent une vue plus réaliste des différents microbiomes présents dans le corps humain et aident les cliniciens à comprendre comment concentrer au mieux leurs efforts lors du traitement de leurs patients.
Les résultats de ce projet ont révélé à quel point notre microbiome est important pour notre existence en tant qu’humains et que les microbes sont dix fois plus nombreux que les cellules humaines! Le microbiome humain est composé d’une partie « centrale » et d’une partie « variable ».14 Le noyau est partagé entre tous les humains, tandis que le microbiome variable est exclusif à chaque individu en fonction de son phénotype, de son génotype et de son mode de vie unique.14 Les différences d’espèces et de souches de cette partie variable du microbiome entre les individus peuvent être aussi uniques que leur empreinte digitale! Cela est également vrai pour le microbiome buccal.
Les microbes ne sont généralement pas présents dans la nature sous la forme d’une culture pure d’une seule espèce, mais existent dans une communauté de microbes, que l’on appelle collectivement un microbiome. Chez l’hôte humain, le microbiome existe dans plusieurs niches anatomiques, chacune ayant ses propres microbiome et métagénome exclusifs, c.-à-d. les cheveux, la peau, le tractus gastro-intestinal, le tractus urogénital, le vagin, les sinus nasaux et paranasaux et la cavité buccale. Dans des conditions idéales, ces niches de microbiome constituent des communautés équilibrées en termes d’espèces qui entretiennent une relation symbiotique en termes de santé. Dans le cas du microbiome buccal, cette relation symbiotique joue un rôle essentiel dans les fonctions physiologiques, métaboliques et immunologiques telles que la digestion des aliments, la production d’énergie et le maintien de l’équilibre entre les processus pro-inflammatoires et anti‑inflammatoires15. Cette homéostasie est possible grâce à la présence à la fois d’espèces commensales (bénéfiques) et d’espèces capables de déclencher des maladies (pathobiontes). Bien que chacun de ces habitants microbiens résidant dans un écosystème unique soit orienté vers des interactions symbiotiques au sein de cet écosystème particulier, si cet état équilibré est perturbé et que les pathobiontes responsables de maladies commencent à dominer les espèces bénéfiques, un état de dysbiose s’ensuit, conduisant à une gingivite initiale. Selon des théories plus récentes, ce déséquilibre se produit lorsque le système immunitaire inné, en déclenchant la réponse inflammatoire dans ses tentatives de maintien de l’homéostasie, échoue lorsqu’il est dominé par certains pathogènes clés qui mènent à cet état de dysbiose entraînant à terme une parodontite16. Cette nouvelle hypothèse inversée pose désormais la question de savoir si ce sont les microbes eux-mêmes ou l’inflammation qui provoquent la dysbiose.
Cependant, cet état de dysbiose explique comment les maladies buccales se produisent, notamment le déplacement microbien de la gingivite vers la parodontite. La cavité buccale abrite le deuxième plus grand nombre de microbiotes après l’appareil digestif. Ainsi, le projet a maintenant permis de développer des bases de données microbiennes spécifiques aux organes : le Human Intestinal Tract et l’expanded Human Oral Microbiome Database (eHomd). À ce jour, près de 800 espèces orales spécifiques ont été ajoutées à la base de données sur les microbiomes buccaux, mais on pense qu’il en existe bien plus de 1 000.
Cette prise de conscience a provoqué un changement de paradigme majeur dans l’identification de l’étiologie principale des maladies parodontales. Ce qui est maintenant considéré comme une théorie dépassée, c’est que des pathogènes parodontaux virulents spécifiques causent la dégradation des tissus parodontaux (principalement les bactéries anaérobies à Gram négatif). Le problème de cette théorie est qu’il n’a jamais été démontré qu’une bactérie spécifique était la seule responsable des maladies parodontales. La nouvelle théorie qui prévaut est donc que la gravité de la maladie varie en fonction de l’environnement du microbe et de l’hôte. La dégradation parodontale chez les individus sensibles crée un environnement propice à certains microbes, qui prolifèrent ensuite. Certains pathogènes clés peuvent être considérés comme des organismes relais et faciliter le passage de la symbiose à la dysbiose chez un hôte sensible. Certains microbes peuvent être présents à l’intérieur de la cavité buccale en bonne santé et maintenir cet état de santé, cependant une interférence avec cet état symbiotique conduit à une dysbiose entraînant une maladie parodontale. Il est également devenu évident, avec ces nouvelles découvertes, que l’objectif principal de l’hygiène buccodentaire devrait être le maintien de la symbiose plutôt que l’élimination de tous les microbes buccaux, au détriment de l’ancien concept selon lequel toutes les bactéries sont mauvaises.
Avec ce changement majeur dans la compréhension des causes sous-jacentes des maladies, une nouvelle approche pour le traitement et la prévention des maladies, qui prend en compte la variabilité individuelle des gènes, de l’environnement et du mode de vie de chaque personne, a été créée sous le nom de « médecine de précision », auparavant appelée médecine personnalisée. La médecine de précision repose essentiellement sur l’identification des approches thérapeutiques les plus efficaces pour chaque patient en fonction des facteurs génétiques et environnementaux et du mode de vie. Cela contraste avec l’approche « universelle » qui a dominé la médecine et la dentisterie traditionnelles pendant des décennies
La commercialisation du microbiome humain en tant que thérapie médicamenteuse a déjà commencé. En 2013, des patients infectés par C. dificile ont été traités avec succès par infusion duodénale du microbiote fécal d’un individu sain!8 La possibilité d’utiliser les informations génétiques et autres informations moléculaires des patients dans le cadre des soins médicaux de routine et peut-être dentaires pourrait bientôt devenir une réalité. Grâce à ces nouvelles découvertes en métagénomique et en microbiomique, il sera plus facile de prévoir quels traitements seront les plus efficaces pour des patients précis. En outre, on comprendra mieux les mécanismes sous-jacents à l’apparition de diverses maladies, ce qui permettra d’améliorer les méthodes de prévention, de diagnostic et de traitement d’un large éventail de maladies.
Parce que chaque individu abrite un microbiome unique qui joue un rôle clé dans l’étiologie de la maladie dans l’organisme, la maladie peut se manifester et progresser différemment selon les individus et cela rend la médecine de précision impérative pour des soins de santé optimaux. Grâce à ces nouvelles connaissances, la nouvelle classification des maladies parodontales est devenue plus axée sur la biologie, englobant le concept de médecine de précision, qui comprend à la fois la dysbiose microbienne et la réponse hyperinflammatoire de l’hôte.
Avec ce modèle en tête, l’idée de créer des définitions de cas de patients plus individualisées s’est concrétisée. En utilisant le modèle médical de classification des stades et de gradation, les auteurs de la nouvelle classification ont pu combiner certains des facteurs généralement utilisés dans la détermination des maladies, tels que la gravité, l’étendue, la vitesse de progression, les facteurs de risque, etc. pour créer une méthode permettant de définir plus précisément les cas individuels. Ce système sera examiné plus en détail au point 5(b) Parodontite.