Mise En Œuvre Du Système De Classification Parodontale AAP/EFP
L’atelier mondial 2017 sur la classification des maladies parodontales et péri-implantaires visait à mettre à jour le système de classification parodontale existant, afin de l’aligner sur notre compréhension actuelle des maladies et des conditions parodontales. Le système de classification mis à jour a comblé les lacunes diagnostiques grâce à l’addition de définitions de cas spécifiques pour la santé parodontale1 et les maladies et conditions péri-implantaires2. Il a également simplifié le diagnostic des maladies parodontales en regroupant la « parodontite agressive » et la « parodontite chronique » sous le diagnostic unique de « parodontite »3. Le changement le plus notable au sein du nouveau système de classification parodontale a été l’ajout d’un système multidimensionnel de détermination des stades et des classements utilisé pour décrire la parodontite.
"Le changement le plus notable au sein du nouveau système de classification parodontale a été l’ajout d’un système multidimensionnel de détermination des stades et des classements"
Les stades représentent un système de gravité à 4 niveaux (de 1 à 4), chaque niveau représentant une forme plus sévère de la maladie. En termes simples, les stades déterminent la gravité et la complexité de la maladie en fonction de paramètres cliniques et radiographiques. Les classements, d’autre part, sont un système de risque à 3 niveaux qui se sert d’une analyse basée sur l’historique du taux de progression de la maladie et la présence de facteurs de risque parodontaux connus (tels que le contrôle de la plaque, le statut tabagique et le contrôle glycémique) pour déterminer le taux de la progression future de la maladie et prédire le résultat du traitement ciblé4.
Compartimenter le système de classification AAP/EFP pour un diagnostic efficace
Chaque fois qu’un changement substantiel est apporté à un schéma de diagnostic de longue date, l’adoption clinique sera difficile : ainsi, ceux qui espèrent intégrer le nouveau système dans leur pratique quotidienne peuvent faire face à l’incertitude et à la confusion lorsqu’ils tentent d’identifier les divers états pathologiques. En tant que parodontiste traitant et enseignant clinique à la faculté de médecine dentaire de l’Université de Toronto, j’ai trouvé utile de compartimenter le système de classification en quatre critères diagnostiques les plus courants.
La santé parodontale clinique est définie par l’absence ou la présence de très faibles niveaux d’inflammation clinique dans le parodonte. Un parodonte cliniquement sain se caractérise par <10 % de saignement au sondage, aucun signe de maladie parodontale active (<4 mm de profondeur au sondage), aucun signe radiographique de perte osseuse et des facteurs de modification et de prédisposition contrôlés (Figure 1)5.
Sans contrôle idéal de la plaque, un changement écologique se produit au sein du biofilm de la plaque, qui passe d’un microbiome sain à un biofilm pathogène. L’accumulation de biofilm pathogène sans perturbation mécanique se transformera en une gingivite causée par la plaque qui se caractérise par des signes cliniques d’inflammation sur un parodonte stable, sans signe de perte osseuse6. Une inflammation gingivale prolongée est une condition préalable au développement de la parodontite et de la perte d’attache autour des dents.
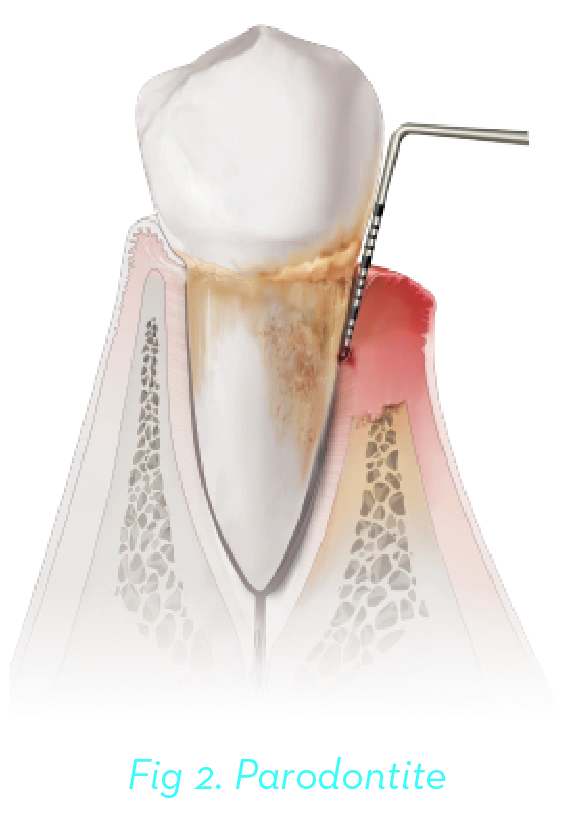
L’apparition de la parodontite se manifeste par une diminution d’attache et une perte osseuse. La parodontite est une maladie évolutive, chronique et irréversible qui, sans reconnaissance ni traitement, aboutira à la perte des dents. La parodontite de stade I et II représente les formes précoces de la maladie qui se prête à un traitement non invasif ou peu invasif. D’autre part, la parodontite de stade III et IV représente des formes évoluées de la maladie qui nécessitera une intervention chirurgicale et nécessite souvent une prise en charge multidisciplinaire avancée (Figure 2)7.
Quel que soit l’état du diagnostic, un régime de soins à domicile prescrit, individualisé, sûr et efficace est un élément clé du traitement de la maladie parodontale et du maintien de la santé parodontale. Pour cette raison, toute l’équipe dentaire (y compris le patient) doit comprendre que la maladie parodontale n’est pas une simple infection bactérienne, mais plutôt une maladie complexe avec une pathogenèse complexe qui implique une interaction entre le microbiome buccal, la réponse inflammatoire de l’hôte, ainsi que des facteurs de modification d’ordre génétique, environnemental et comportemental8.
"un régime de soins à domicile prescrit, individualisé, sûr et efficace est un élément clé du traitement de la maladie parodontale"
Nous avons tous observé comment le manque d’assiduité des patients et les mauvaises pratiques de soins à domicile peuvent exacerber la gravité de la maladie (stade plus élevé), accélérer leur taux de diminution d’attache et diminuer leur réponse à nos efforts de traitement (risque plus élevé).
Faire des recommandations fondées sur des données probantes
Nos patients ont à leur disposition les moyens pour lutter contre la carie dentaire et les maladies parodontales. Nous devrions leur insuffler la confiance pour prendre le contrôle de leur santé buccodentaire pour continuer nos soins au-delà du fauteuil dentaire. Il est de notre responsabilité de guider nos patients vers l’utilisation des outils les plus éprouvés et efficaces à leur disposition. Dans mon cabinet, quel que soit l’état diagnostique de mon patient, je recommande l’utilisation d’une approche à trois volets pour les soins buccodentaires à domicile : brosse rotative oscillante, dispositif interdentaire et un dentifrice au fluorure stanneux stabilisé (SnF2). Des études ont montré que la perturbation mécanique du biofilm reste la norme de référence et est obtenue en toute sécurité chez les patients utilisant des brosses à dents électriques oscillo-rotatives et des dispositifs interdentaires9. Les dentifrices au SnF2 offrent un net avantage par rapport aux dentifrices ordinaires au fluorure de sodium, car ils peuvent réduire la production métabolique de toxines bactériennes10, supprimer la virulence des agents pathogènes11 et favoriser la symbiose bactérienne et hôte12.
Les effets thérapeutiques du SnF2 ont été mieux démontrés par Biesbrock A et al. qui a démontré 3,7 fois plus de chances de passer d’un état de gingivite à un état sain par rapport à un dentifrice au fluorure de sodium (ou MFP) à témoin négatif utilisant la formule au SnF2 de Crest13.
Les effets synergiques de l’utilisation d’une brosse électrique intelligente oscillo-rotative, d’un dentifrice au fluorure stanneux stabilisé, d’un rince-bouche à 0,07 % de chlorure de cétylpyridinium (CPC) et de soie dentaire ont également été mis en évidence par une transition de 100 % des patients atteints de gingivite vers la santé clinique après un essai de 12 semaines (Figure 3)14.
Conclusion
Les patients ne bénéficieront pas de nos traitements réparateurs, prothétiques ou parodontaux en cabinet s’il y a une routine de soins à domicile inadéquate entre leur rappel et les rendez-vous de reprise des soins. Les dentistes, les spécialistes dentaires et les hygiénistes dentaires doivent travailler ensemble au sein de la profession dentaire en tant qu’« équipe de soins alliés » pour éduquer et motiver nos patients à l’égard des effets des comportements des patients et des soins à domicile médiocres sur leur santé buccodentaire.